Kleine Moleküle zur Manipulation von Leukozyten
K. Schmitz
K. Schmitz, Institut für Organische Chemie, Karlsruher Institut
für Technologie, Fritz-Haber-Weg 6, 76131 Karlsruhe
Email:
katja.schmitz@kit.edu
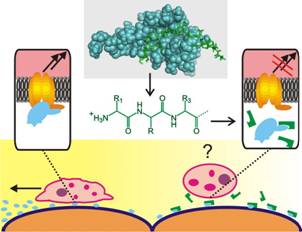
Die
übermäßige Einwanderung von Leukozyten in entzündetes Gewebe ist ein Merkmal
zahlreicher Erkrankungen wie Asthma, Schuppenflechte oder Arthritis. Dabei
folgen die Leukozyten einem Gradienten von Chemokinen, kleinen Proteinen, die
als Reaktion auf entzündliche Reize ausgeschüttet werden und Rezeptoren auf den
Immunzellen aktivieren.
Auf der Suche nach Inhibitoren
für die Chemokin-Rezeptor-Wechselwirkung wurden
Mikroarrays mit biologisch aktiven kleinen Molekülen auf Bindung an ausgewählte
Chemokine gescreent.[1] Darüber hinaus wurde eine Bibliothek von
Peptiden und Peptoiden synthetisiert, die an das ELR-Motiv des Chemokins
Interleukin-8 binden sollen, das notwendig für die Aktivierung des Rezeptors
ist. In einem rationellen Ansatz wurden Komplexe ausgewählter Chemokine mit
Teilstücken ihrer Rezeptoren im Computermodell betrachtet. Der Austausch
einzelner Aminosäuren der Rezeptorpeptide in diesem Modell erlaubt eine
Vorhersage über Änderungen in der Bindungsenergie und damit die Identifikation
von Aminosäuren, die für die Bindung essenziell sind.[2]
Alle Leitstrukturen werden zurzeit über Fluoreszenzpolarisation
oder Oberflächenplasmonresonanz auf ihrer Bindung an rekombinant exprimierte
und gereinigte Chemokine getestet. Darüber hinaus wird ihre biologische
Aktivität in Chemotaxis- und Aktinpolymerisationsassays untersucht. Moleküle,
die stark an die Chemokine binden und die Migration von Leukozyten
unterdrücken, werden als Kandidaten für Wirkstoffe gegen entzündliche
Erkrankungen weiterentwickelt.
[1] K. Schmitz, S. J.
Haggarty, et al., J. Am. Chem. Soc. 2007, 129, 11346-7.
[2] I. Meliciani, K. Klenin, et al.,
J. Chem. Phys. 2009, 131, 034114.